公司新闻
Company News
新闻中心 | 公司新闻 2892次阅读 2016-07-14 00:00
The following article is from 乐康智库 Author 乐康智库

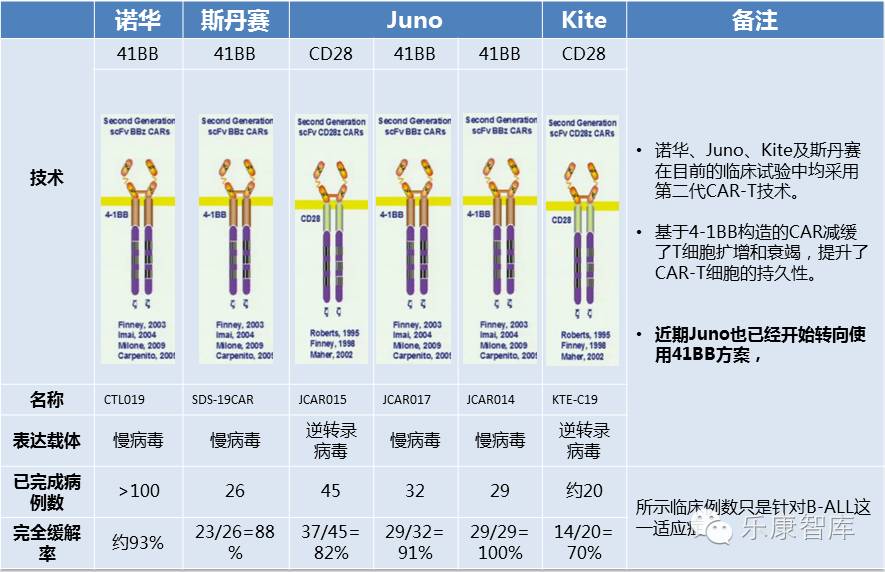
CAR-T领军企业Juno刚宣布,FDA批准其ROCKET临床试验可以继续进行。
这项2期临床试验旨在通过CAR-T疗法,治疗复发性或难治性的B细胞急性淋巴细胞白血病。上周两名患者在经治后由于出现脑水肿而去世,被FDA暂停临床试验。
ROCKET试验中的JCAR015是Juno的领先产品,原本有望在2017年进入市场,但上周的意外将上市计划无限推迟。在FDA快速批准下,JCAR015或能保持原有上市计划。
Juno之CAR-T事故,为啥没成美版“魏则西事件”?《乐康智库》分析:一是两名患者是在临床试验中出现脑水肿去世,二是受益于Juno公司CEO今年5月来上海进提及的“互动式监管”。
“在第一例死亡病例出现后,我们立刻暂停了这项临床试验,并同FDA以及公司内部的数据安全监测委员会进行了复审。”Juno的首席执行官Hans Bishop先生在7月7日说道。
暂停试验之后,Juno按FDA要求对四项材料进行修订,其中包括患者知情同意书与试验方案。
FDA先前表示对Juno材料的审查最多需要30天的时间,而在美国当地时间周二,FDA就将材料审阅完毕,并同意恢复ROCKET试验。
上海细胞治疗工程技术研究中心主任钱其军表示,在意料之中,FDA这么快就批准Juno恢复临床试验。值得国内同行认真学习,对出现的问题应理性分析,而不是一棒打死,更不是把整个细胞治疗行业都扼杀了。
据《乐康智库》了解,魏则西事件之后,细胞治疗是按新药研发还是医疗技术监管,卫计委和CFDA仍在沟通商讨中。无论哪种监管方式,Juno之CAR-T事故都是一个值得学习的监管案例。
近日,《乐康智库》也访谈了博生吉医药创始人杨林博士。他说,政府若能出台科学的管理规范,将会是我国细胞治疗行业走向健康发展之路的开始。
博生吉是一家致力于肿瘤细胞免疫治疗技术的研发与创新的新锐企业,在血液肿瘤和实体肿瘤的临床试验中,都积累了十分宝贵的临床经验。
去年年底,上市公司安科生物(300009)出资2000万元获得博生吉15%股权,今年2月又公告称拟增资750万元将股权提高至20%。
杨林表示,博生吉与安科生物合作,有望助博生吉实现发展理念与企业价值。
问
癌症已成为危害人类健康的大敌,你如何看细胞免疫治疗对癌症治疗的价值?
答
癌症的治疗一直是医学上的重大课题。在1990年前,癌症的治疗手段基本上是以手术、放化疗为主;1990年到2010年期间,分子靶向药物发展很快,成为了主要的治疗手段之一;从2010年开始,以激发患者免疫系统为主要目的的免疫治疗在临床上获得了显著的进展,正在改变着肿瘤治疗的大方向,成为了肿瘤治愈的希望。
在癌症免疫治疗中,细胞治疗扮演着关键的角色,特别是以肿瘤抗原特异性为特色的细胞治疗,比如:CAR-T、TCRT等治疗策略,正在成为免疫治疗中最具前途的方向之一,具有十分重大的临床价值。
问
从临床研究来看,细胞免疫疗法在哪些肿瘤上有望取代传统疗法?
答
细胞免疫疗法在治疗某些血液肿瘤,比如:B急性/慢性淋巴白血病、B细胞来源的淋巴瘤上面,已经取得了令人震惊的疗效,比如:难治、复发的B-ALL(B急淋)患者,在接受CD19-CAR-T治疗后,完全缓解率高达90%以上。对于这样的适应症,细胞治疗完全可以取代传统疗法。
当然,细胞治疗在治疗其他肿瘤类型上还面临诸多挑战,技术本身还有很长的发展道路要走,例如:在治疗实体肿瘤时,依靠单一靶点的CAR-T细胞治疗就显得力不从心,这时候细胞治疗必然要与其他治疗手法相结合,也包括传统的放化疗。传统的放化疗虽然在彻底清除肿瘤细胞方面有很多不足之处,但是这些治疗手段导致的部分肿瘤细胞死亡却能促进肿瘤抗原的释放,刺激患者T细胞的抗原识别与活化,因此CAR-T细胞治疗如能同时与这些促进肿瘤抗原释放的传统疗法相结合,必将可以提高细胞治疗的效果。
也就是说,细胞疗法的发展,在很多肿瘤类型的治疗上,将有可能进一步促进传统疗法的发展,以联合治疗的方式来达到最佳治疗效果。
问
在人类攻克癌症的战争中,以CAR-T为代表的细胞治疗和PD-1为代表的抗体药被寄以厚望。正如你所说,两者有没有可能联合起来寻找最佳疗效?
答
以CAR-T细胞治疗为例,在治疗实体肿瘤时,由于肿瘤抗原靶点难寻、肿瘤免疫抑制微环境的破坏等因素,仅靠识别单一靶点的过继性CAR-T细胞回输治疗,是很难确保安全性与有效性的。
首先谈一下靶点。由于CAR-T细胞识别的是肿瘤相关抗原(TAA),这些TAA在正常细胞上的表达会导致出现on target、off tumor的脱靶毒性,这就使得回输的CAR-T细胞剂量很难采用能够达到有效剂量的程度,因而大大影响了疗效。
但更重要的是,实体肿瘤细胞是遗传异质性的,仅靠单一靶点是无法识别所有肿瘤细胞,因此在针对实体肿瘤治疗时,不能仅仅依靠单一靶点的过继性细胞回输,而是还需要要能够同时充分激活和调动患者体内的TIL(具有肿瘤识别能力的、在肿瘤组织中浸润的T淋巴细胞),才能达到对肿瘤细胞进行更有效杀伤的目的。这种情况下,结合其他治疗手段,比如可以导致免疫原性肿瘤细胞死亡的靶向治疗或者放化疗。
在实体肿瘤治疗中遇到的另一个障碍是肿瘤免疫抑制微环境,这样的微环境对于CAR-T细胞是恶意的,会阻碍CAR-T细胞对肿瘤的归巢与识别、以及杀伤。打破免疫抑制微环境,就成为了实体肿瘤治疗时必须要克服的困难。
在这方面,新兴的抗体药物,比如PD-1 、CTLA-4等抗体药物,将会起到很大的协同促进作用。例如,通过PD-1 抗体药物阻断肿瘤细胞高表达的PD-L1分子对T细胞表面的PD-1 分子的结合,克服T细胞因为PD-1 信号通路被激活而出现的耗竭。
问
从临床试验来看,博生吉的细胞疗法取得哪些优势?
答
在血液肿瘤方面,我们以临床上面临最大挑战的T细胞肿瘤为目标,开发靶向CD7分子的CAR-NK细胞治疗技术,自主开发的CD7纳米抗体已经申报国际专利。
在实体肿瘤方面,我们选择的MUC1靶点是治疗实体肿瘤时一个难得的优良靶点,它不仅在肿瘤细胞高表达,而且其本身的与正常细胞不一样的糖基化修饰,为这个靶点的CAR-T治疗提供了安全保障。我们在做CAR-T治疗时,有个别患者能够在单独肿瘤病灶上实现完全缓解(CR),在国际上CAR-T治疗实体肿瘤几乎都没有看到疗效的情况下,我们的结果是十分令人鼓舞的。
今年上半年我们还开展了7例实体肿瘤的MUC 1-CAR-NK细胞治疗,这也是国际上第一次大规模的CAR-NK细胞治疗临床试验,积累了十分宝贵的临床经验,还获得了一些可喜的进展。这些患者均是IV期的晚期患者,已经没有其他治疗选择了,治疗试验显示大部分患者在影响学上表现出了疾病稳定(SD)。一些具有可监测的肿瘤血清学指标的患者,出现了肿瘤血清标志物的大幅度下降。我们将密切观察后续这些患者的情况,以获得最终的临床结论,因为实体肿瘤的疗效评估需要较长的时间。
问
魏则西事件后,卫计委叫停细胞治疗的临床应用,转为临床研究,对博生吉有何影响?
答
最直接的影响是,博生吉与浙江武警、安徽武警医院的合作停止了。当初选择部队医院的确是受当时的大环境影响,因为地方医院在通过医学伦理时流程更长。
今年开展的临床试验是与地方三甲医院——合肥第一人民医院滨湖医院合作开展的,接下来还会与另外几家地方三甲医院合作,进行更多的临床试验。
问
对细胞免疫治疗整个行业发展的短期和长期影响有哪些?
答
从短期来看,对主要依靠市场营销模式开展细胞治疗服务的企业是一次重大打击,但从长远看,如果政府真能出台科学的管理规范,将会是我国细胞治疗行业从此走向健康发展之路的开始。
我衷心希望政府部门能够珍惜这次机会,尽快出台管理制度。对我们自己公司,更加坚定了走技术研发、临床试验的道路。对其他企业,也是一次难得的转型机会。
问
目前,对于细胞治疗的临床研究、技术审核、以及临床准入的监管?国外有哪些成熟的经验?
答
国内正如前面所提及,目前的状况是没有可以操作的监管政策。在国外,CAR-T细胞行业发展最快、最完善的国家是美国。美国在管理上是严格的临床1-3期试验模式,按照新药进行监管。在我国台湾地区,通过第一阶段安全性人体临床试验后,可以在教学医院进行患者付费的细胞治疗。美国模式和台湾模式对于我国均有借鉴作用。
美国的新药研发模式会有利于整个行业的长远发展,但在短期内,会对大部分企业、医疗单位造成冲击。台湾模式会更快地在短期内就促进行业的发展,但后续的监管如何落实到位是一个难题,对大规模产业化的发展也会有一定的影响。
问
在魏则西事件之前,细胞免疫疗法是按新药,还是医疗技术监管就存在争议,目前仍未达成共识,为何为出现这种分歧?
答
出现这种分歧的主要原因是我国与西方国家发展模式的不同。国内在技术开发上唱主角的各大医院的一大批优秀的科主任和临床大夫,他们为我国的细胞治疗技术的发展做出了重大贡献。
国际上,主要是以企业推动行业的发展,在政府的监管下,企业依托医院开展临床试验,也就是说,国际上企业扮演了十分重要的角色。
我国的这种医院具有重大影响力的特色,在推动产业化、建立商业模式上就遇到了困难,也导致了我国鲜有具有国际影响力的细胞治疗公司出现。
这也是为何会出现CAR-T究竟是按照技术、还是按照药品来管理的争论。如果按照药品管理,企业将会扮演关键性的作用,也将有利于整个行业的健康发展。
真正健康的产业环境,是技术研发主要在大学、研究所;企业通过收购、自主研发等途径,将这些新技术产业化,以新药模式在CFDA监管下开展临床试验;而医院则承担起了临床试验研究的重任。
这样的相互分工与配合,是最有利于行业的发展的。否则,医院自主研发、自主开展临床研究的模式,虽然可以带动学术的发展,但对行业的发展却不是最优化的。
问
在你看来,未来监管方向会是什么?
答
虽然国内在为细胞治疗是按照医疗技术还是新药模式监管争论不休的时候,我们本着企业和技术发展本身的逻辑来进行布局,从一开始就按照新药开发模式来制订技术发展思路。如果国家将来有一天采用美国FDA的新药模式进行管理,我们可以用最快的速度进入临床申报轨道。如果国家仍然按照技术管理的模式,但我们的新药管理理念只会使我们的技术更具竞争力。
这个问题本身很简单,之所以今天会成为一个麻烦,是因为以前制订的三类医疗技术管理模式使得这个行业的准入门槛较低,而且还能未经临床试验就开始收费。
如果按照新药研发模式,严格开展临床试验,并给予某些产品药物突破性资格以获得快速批准的可能性,那么这个方面的政策风险就不再存在了,还能起到鼓励有核心技术的公司积极加入进来的作用。
问
监管之外,细胞疗法面临的另一个难题是,如何产业化?
答
目前主流的细胞治疗技术是以个性化制备的CAR-T细胞技术为主。这样的技术在产业化方面存在诸多问题,包括:
无法大规模制备CAR-T细胞,因为每份细胞都必须个性化制备;
细胞产品标准很难统一,因为每个患者的免疫力都不同,导致CAR-T细胞的活性也不一样。同时,每个患者的T细胞在进行CAR-T制备时,转染效率也不一样;
存在CAR-T细胞制备失败的风险,因为并非每个患者的T细胞都一定能够制备成功成为CAR-T细胞。美国这个行业最领先的公司之一诺华,平均制备失败率也高达12%以上;
伴随着个性化制备技术体系,是复杂和繁琐的质控,也因此进一步提高了产品的成本。
问
产业化难也导致CAR-T疗法价格昂贵?有报道称,美国CAR-T疗法单次价值高达30-50万美元。
答
要使细胞治疗技术真正应用于我国的癌症患者,如何降低技术成本、如何实现标准化制备与治疗流程等,就成为了技术开发公司的主要课题与任务。
通用型的CAR-T细胞是解决问题的出路之一。随着基因编辑技术的进一步成熟和便利,制备通用型的异体CAR-T细胞已经成为可能。这种异体CAR-T细胞,真正实现了将CAR-T细胞作为活的药品的理念,大幅度降低了成本,而且可以标准化很多环节。当然,异体CAR-T细胞还只是处于初期发展阶段,需要完善和改进的地方还有很多。
博生吉一直以实现产业化作为发展的主要目标,也在积极布局异体CAR-T细胞的研发,率先在国际上开展了异体CAR-NK细胞的临床试验。
问
能否介绍下博生吉正在探索的商业模式?
答
选择了这个行业,就要明白新药研发没有捷径可言。所以,博生吉的商业模式一直定位在技术研发、临床试验、最终实现临床应用的这样一种发展路径上。
短期来讲,企业是不可能实现盈利的。这就是这个行业带来的挑战,它考验的是企业是否有真正经得起临床检验的核心技术、考验的是企业是否能够坚持下去。很多企业可能会因此而退出,但一定会有企业最终实现其价值的。
在国际上,新药研发企业可以通过走向资本市场来实现其可持续发展的商业模式。在我国,这样的模式会走的很难,但博生吉幸运的是与安科生物实现了合作,使得博生吉有望实现其发展理念与企业价值。