公司新闻
Company News
新闻中心 | 公司新闻 5000次阅读 2019-01-21 15:04
新年之初,笔者邀请了国内CAR-T领军者博生吉董事长杨林教授分享了在他眼中2015年CAR-T领域发生的令他印象深刻的事件,分析了CAR-T疗效、价格、产业化以及技术改进等方面的问题,阐述了国内CAR-T市场的临床、资本以及政策现状。 |

2014年,Kite、JUNO惊人的揽金速度以及在当年ASH年会上CAR-T疗法的多项研究喜讯让这一癌症免疫疗法选手的实力逐渐浮出水面。进入2015年后,CAR-T疗法吸引了越来越多国内外企业的目光,科学界也在不断开发更精准的同类系统。
若是在2014年问起哪些公司是国内CAR-T市场的主要力量,可能答案并不会太清晰。然而,经过2015年的飞速发展,中国已经涌现出一批包括博生吉在内的,兼具强大研发实力和临床应用能力的CAR-T公司与团队。此外,包括恒瑞医药、安科生物、银河生物在内的多家上市公司开始涉足这一领域。
资本的青睐让CAR-T疗法的热度不断攀升。然而,CAR-T疗法的细胞因子风暴等副作用、高达几十万美元的治疗价格、对实体瘤的“束手无策”以及产业化困难等问题却依然没有能够很好的解决。
去年4月,笔者有幸采访了博生吉医药科技(苏州)有限公司的董事长兼首席科学官杨林教授,探讨了CAR-T疗法的发展历史、现状、瓶颈及前景等问题。尽管相隔不到一年的时间,但在科学研究、公司发展和市场动向方面,CAR-T治疗领域却发生了很大的变化。
新年之初,笔者再次邀请了杨林教授与我们分享了在他眼中2015年CAR-T领域发生的令他印象深刻的事件,分析了CAR-T疗效、价格、产业化以及技术改进等方面的问题,阐述了国内CAR-T市场的临床、资本以及政策现状,总结了博生吉在2015取得的重要成果,且表达了对公司未来发展方向的预期。

博生吉医药科技(苏州)有限公司董事长兼首席科学官 杨林教授
2015年CAR-T领域印象最深刻的3件事
1. 诺华CTL019高达93%的完全缓解率
12月5日,诺华在ASH会议上公布了其靶向CD19分子的CAR-T(CTL019)在治疗难治、复发急性淋巴性白血病(ALL)方面的2期临床数据,2期数据与2014年公布的1期数据惊人的相似,完全缓解率(CR)分布高达93%(55/59)和92%(36/39)。
杨林教授表示,不出意外的话,CTL019一定会在1年左右内被美国FDA正式批准应用于临床治疗,这将是人类历史上的一个里程碑事件,意味着在治疗恶性肿瘤方面,至少在针对ALL方面,人类首次实现了治愈癌症的梦想。
2. 异体CAR-T领军者Cellectis吹响了产业化的号角
12月7日,在同一会议中,Cellectis展示了其异体CAR-T疗法(UCART19,是通过基因编辑技术TALEN敲除TCR的异体CAR-T细胞)的重要结果。Cellectis将UCART19在一例11个月婴儿ALL患者身上进行了临床试验,在分子水平获得漂亮的缓解数据。杨林教授说:“这项临床试验应该说吹响了CAR-T技术产业化的号角,为未来CAR-T真正大规模走上临床开创了可能性。”
3. 中国在CAR-T领域的异军突起,临床试验数量已接近美国
2015年,中国在CAR-T领域异军突起。从美国clinicaltrials网站注册的情况看,据不完全统计,尽管中国在这个领域起步较晚,但2015年中国新增加的CAR-T临床试验数量已接近美国,分别为中国15项和美国17项。而从适应症来看,中国有高达8项在进行非B细胞肿瘤的实体瘤临床试验,而美国17项总的临床试验中,仅有5项是非B细胞肿瘤的实体瘤方面的临床试验。杨林教授分析道,这意味着中国有望依托庞大的实体瘤患者群体,以及饱满的CAR-T研究激情,取得后发优势,在实体肿瘤方面获得更大成果。
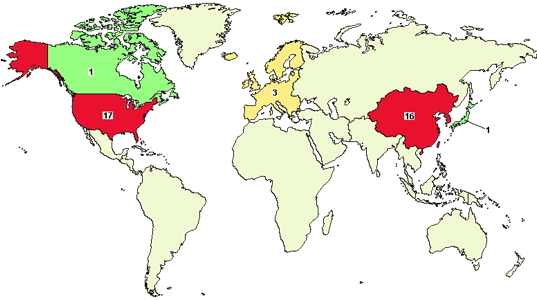
注解:图中的16包含了日本的1项临床试验
关于CAR-T疗效、价格、产业化
生物探索:对于目前CAR-T疗法的细胞因子风暴、脱靶毒性和神经毒性等问题,应该从哪些方面着手解决?
杨林:目前在CAR-T领域进展最为突出的针对CD19靶点的临床治疗,而其它肿瘤类型由于案例数量有限,因此可以总结的地方还不多。就CD19的CAR-T治疗来看,特别是CTL019的实际应用结果来看,有几点值得注意:
1. 就CTL019来看,淋巴因子风暴主要与肿瘤负荷有关,与CAR-T细胞回输剂量无关。比如,少于20%肿瘤负荷的患者,发生严重淋巴因子风暴的可能性几乎没有。
2. 至于脱靶毒性,在CTL019的治疗中,所有有效的患者均会出现脱靶毒性,其后果是患者长期处于B细胞发育不全症。但幸运的是,这样的脱靶毒性不仅是疗效的前提,而且患者耐受性也很好,可以通过静脉补充免疫球蛋白来预防风险。然而,这是针对CD19靶点的特殊案例,在其它靶点和适应症的治疗上,严重的脱靶毒性是需要认真应对的,因为这样的脱靶毒性可能是致命的。其应对措施一个是抗体技术的完善,一个是安全措施的实施,比如自杀开关、或者其它多功能、多靶点CAR的应用等。
3. 神经毒性是另外一个需要重视的问题,实际上,JUNO公司的JCAR014在治疗非霍奇金淋巴瘤(NHL)的时候,高剂量的CAR-T细胞会引起严重的神经毒性(67%),这也是近期拖累JUNO股价的原因之一。当然,JUNO公司对此也很重视,他们研究发现高肿瘤负荷以及CAR-T细胞在体内的大量增殖是导致严重神经毒性的主要原因,因此他们也在开展新的临床试验,试图通过优化剂量来减少这些副作用。总之,CD19-CAR-T临床试验告诉我们,CAR-T细胞在患者体内的存活时间、增殖倍数与疗效是密切相关的;而肿瘤负荷是产生严重毒副作用的主要因素。
生物探索:CAR-T回输到体内后会扩增,如何定义剂量问题?
杨林:从CTL019的临床数据看,CAR-T细胞进入患者体内后可产生高达1,000到10,000倍的扩增。同时,我们也能看到不同患者之间扩增倍数相差可达10倍以上,而这种差距与患者自身的免疫环境以及CAR-T细胞的活性与质量是有关联的。这就为我们制定标准回输剂量带来了困扰。
然而,针对CTL019治疗ALL的临床试验也显示出不同剂量的CTL019对患者的临床应答没有产生显著影响。因此,以CD19+的血液肿瘤为例,CAR-T细胞的儿童患者回输剂量在1-17.4x106/公斤体重、成人患者在1x107-2x109均产生了良好的疗效。实体肿瘤的剂量还有待更大规模的临床试验来验证,而且由于实体肿瘤在微环境、异质性、胞外基质、瘤内缺氧等诸多障碍下,剂量的确定无疑是一个严峻挑战。
由于我们始终认定异体CAR-T、CAR-NK的发展会成为一个方向,因此借助异体CAR-T和CAR-NK易于标准化的优势,剂量的确定也许会成为现实。
生物探索:不同病人的免疫系统不同,如何保证CAR-T的疗效?CAR-T疗法离治疗流程标准化是否还有很长的路要走?
杨林:不同患者的免疫环境和微环境存在较大差异,这显然在某种程度上制约了CAR-T的疗效,再加上个性化的CAR-T细胞制备,更加进一步影响了治疗流程标准化的建设;甚至在每次临床试验中,总会出现某些患者的CAR-T细胞制备失败,而不得不退出临床试验的情形,不得不令人感到遗憾。解决这些问题的出路之一还是我们反复强调的异体CAR-T或者CAR-NK技术的完善。
生物探索:根据预测,CAR-T疗法在美国的价格可能达到单次治疗25-40万美元。那么,预计国内的CAR-T疗法价格会在怎样的范围?市场前景如何?
杨林:CTL019如果2016年或者2017年获批的话,其售价确实预计在25-40万美元左右。因为诺华的每例患者CAR-T细胞制备成本在5万美元左右,加上前期研发费用的回收,因此才会出现如此高昂的治疗收费。不过预计美国政府会批准这样的收费标准,因为如果单次治疗就可以解决患者后续的问题,那么从长远来看这样的收费并不算昂贵了。
中国何时能够获批临床应用还是一个未知数,况且目前还处在靠自律来开展临床试验的阶段,政府或者CFDA的监管暂时不知何时到位,因此谈中国的收费似乎还太早。不过我们也曾大胆推测过,如果CAR-T技术被批准应用于血液肿瘤的治疗,收费在30万人民币上下应当是合理的,这也是根据在中国的研发投入和制备成本来推算的。当然,如果未来异体CAR-T产品被批准了,单次治疗收费降到5-6万人民币也不是不可能。
至于市场前景,中国作为癌症大国,每年新增肿瘤患者300多万,但最糟糕的是与美国肿瘤患者五年生存率能达到81%,日、英等国也能达到65%左右相比,中国五年生存率只有25%左右。这就为类似CAR-T这样的新技术在中国的应用提供了巨大的发展空间。
由于免疫治疗正在成为肿瘤治疗中的共识,所以曾经有人预测中国未来3年内会有数百亿元人民币的免疫治疗市场规模。不过CAR-T治疗在针对实体肿瘤时存在适应症狭窄、靶点难寻的严重问题,所以尽管市场潜力巨大,要想实现真正的经济效益和市场规模,还任重道远。但有一点是我们坚信的,那就是前途肯定光明。
生物探索:CAR-T疗法除了疗效和安全性待进一步提升,产业化问题也一直是关注的焦点。解决这一问题主要需从哪些方面入手?
杨林:CAR-T产业化瓶颈一直是我们强调的,这个问题在各种会议或者访问时,我们都一直在探讨。从国内的反应来看,对这个问题重视的人或者单位还不多,这可能与国内CAR-T的发展现状与国际的发展模式有明显差别造成的。在国内,一流的技术团队和PI大多集中在顶尖研究单位和医院里,他们在技术的研发和临床试验上取得了令人瞩目的成就。而在国际上,CAR-T技术的推广主体是各个CAR-T技术公司,他们必须解决产业化问题才能在竞争激烈的CAR-T领域最终胜出。
所以,从国情上看,在中国占据主导地位的医院和研究单位不会存在较大的产业化压力。不过随着产业环境的进一步完善,从事CAR-T技术研发与应用的公司越来越多,产业化最终肯定会成为大家关注的焦点。解决这个问题,就我们的分析来看,主要还是我们过去一直强调的三个环节:异体CAR-T细胞技术、CAR-T制备自动化、冷链运输。这三个环节缺一不可,它们是决定CAR-T是否能够产业化成功的关键要素。
关于技术改进:异体CAR-T、CAR更新换代、CRISPR加盟
生物探索:去年年底,Cellectis的异体CAR-T疗法取得一定的成果,据称这种疗法如果可行会将治疗费用降至5-10万美金。那么,目前,全球在异体CAR-T领域的投入如何?
杨林:Cellectic公司一直致力于异体CAR-T技术的开发,并最终在一个11月婴儿ALL患者身上实现了临床应用。异体CAR-T技术的T细胞采自健康供体,理论上一个健康供体的T细胞可制备数百名患者需求的CAR-T细胞,因此制备成本可以大幅度下降到1万美元以下,这就为他们的异体CAR-T技术产品收费5-10万美元创造了条件;此外,生产效率以及质控管理都将得到极大改善。
Cellectis公司的技术实际上已经给其它CAR-T公司带来了压力。例如,JUNO公司近期公布了与Editas Medicine的合作,利用后者的CRISPR-Cas9来改造更为高效廉价的CAR-T或者TCR-T细胞。当然,JUNO的竞争对手诺华也没有闲着,实际上诺华比JUNO还更早与CRISPR-Cas9技术公司合作,诺华的合作对象是Editas的竞争对手Intellia Therapeutics公司。虽然诺华和JUNO还没有完全披露他们在这个领域的研究细节,但可以推测异体CAR-T或者TCR-T细胞应该是主要研究内容之一。
生物探索:有国外专家将CAR-T疗法比作生物科技界的iPhone,更新换代特别快。您如何评价这一观点?目前,CAR主要从哪些方面进行优化改造,是否新一代的CAR就更优于前一代?
杨林:这个比喻确实十分恰当。早在去年8月份Carl June先生就曾提出现在CAR-T是1.0时代,而Windows系统已经到了10.0。即使是CAR-T 1.0,我们已经能够感受到技术上的不断推陈出新,比如,CAR-T结构被进一步优化、抗体亲和力的重要性被不断更新、安全性技术被不断引入、基因编辑的应用以及免疫检验点抑制共同联用等等。
就现阶段来看,所谓的第2、3、4代CAR还存在不少争论。但随着临床研究的进一步扩大,已经逐渐清楚第2代CAR中如果使用CD28,主要会影响CAR-T细胞的细胞毒性,特别是会造成CAR-T细胞活性的耗竭;而使用CD137则会对CAR-T的体内存活起到更大的作用。有人采用CD28、CD137联合的第三代CAR,但尚未有值得信服的证据表明这样的联用效果更佳。
其实,还有一点十分值得警惕,就是CD19-CAR-T虽然取得了不可思议的成功,但是推广到其它靶点的时候却失望居多。已经有报道发现CAR结构中的一个关键分子CD3ζ会由于不依赖于抗原识别的单链抗体形成的多聚体导致其过度磷酸化,从而最终造成CAR-T细胞功能的过早耗竭。这种现象在CD19靶点的CAR-T治疗中没有发现,却不同程度上普遍存在于其它靶点的CAR-T治疗中。因此,可以看出,共刺激分子的优化工作对CAR-T的疗效有着关键的作用。此外,第4代CAR的研究也值得关注,比如引入IL-12分子来改善肿瘤免疫抑制微环境,或者引入趋化因子来增强CAR-T细胞的归巢性等。
另外,即使在较为成熟的CD19-CAR-T领域,疗效较为显著的CTL019治疗ALL患者时,也有高达30% 的CR患者仅仅维持1个月左右的CR就出现复发。这些复发2/3是由于CD19抗原丢失造成的,1/3则是由于CTL019细胞存活仅仅维持了3-6个月所致。因此,改善CAR-T细胞的存活非常重要,同时开发备用靶点来应付CD19抗原丢失也是十分必要的,比如CD22靶点的CAR-T。
生物探索:诺华和JUNO纷纷与专注于CRISPR技术的公司开展合作。这是否将成为一种趋势?博生吉在这方面是否有相关的布局?
杨林:总体来讲,基因编辑技术进入细胞治疗一定是大势所趋,将细胞治疗比喻为进入了基因编辑时代并不夸张。从技术层面上看,TALEN和CRISPR-Cas9技术对原代T细胞进行基因编辑已经不是太大的技术障碍。因此,细胞治疗与基因编辑技术的“联姻”生逢其时,也揭开了基因编辑技术为基础的细胞治疗的序幕。
博生吉在这方面一直十分关注,也正在努力进行异体CAR-T和异体CAR-NK技术的开发。近期,团队即将就我们开发的异体CD7-CAR-pNK技术进行针对T淋巴细胞肿瘤的临床试验。
然而,有一点需要指出的是,CRISPR技术的专利保护应该是不能回避的一个障碍。尽管在目前临床前和临床试验阶段,这些都还不是问题,但如果将来一旦形成产业化,专利问题必将提到桌面上来了。其实,不管是CRISPR,CAR的结构本身也有专利之争。博生吉在这方面除了开发自主知识产权的(比如:CD19、CD138、CD7、MUC1等)抗体序列外,在CAR-T结构上也不断创新。